Hallo teman teman
minggu lalu kita sudah membahas mengenai sintesis sintesis organic kemudian
pada pertemuan ini kita akan membahas kekuatan asam basa dalam kimia organik


Adapun kekuatan relative
dari asam basa dapat ditentukan dari konstanta ioniasasinya
serangkaian asam dan basa dalam urutan kekuatan menurun dari asam dan peningkatan kekuatan basa yang sesuai. Asam dan basa dalam baris yang diberikan saling berkonjugasi satu sama lain
Asam organik adalah senyawa organik yang
mempunyai derajat. Asam organik yang paling umum adalah asam alkanoat yang
memiliki derajat keasaman dengan gugus karboksil -COOH, dan asam sulfonat
dengan gugus -SO2OH mempunyai derajat keasaman yang relatif lebih kuat.
Stabilitas pada gugus asam sangat penting dalam menentukan derajat keasaman sebuah
senyawa organik
Asam karboksilat merupakan senyawa organik yang bersifat
asam. Asam karboksilat, asam sulfonat (RSO3H) dan alkil
hidrogen sulfonat (ROSO3H) merupakan
senyawa organik yang memiliki kekuatan keasaaman lebih tinggi dari pada asam
karbonat. Kekuatan asam suatu senyawa dinyatakan oleh Ka atau pKa sedangkan untuk kekuatan kebasaan dinyatan olek Kb atau
pKb. Dimana nilai Ka ataupun Kb berbanding terbalik dengan nilai pKa ataupun pKb.
Contoh asam
organik sebagai berkut:
Asam asetat lebih asam karena basa konjugasi
dari asam asetat dapat mengalami resonansi yang meningkatkan kestabilan sehingga memiliki kekuatan asam
yang lebih besar dari pada methanol dan aseton.
Kekuatan asam lemah
diukur pada skala pKa. Semakin kecil angkanya pada skala ini, semakin kuat asam
tersebut. Tiga dari senyawa yang akan kita lihat, bersama dengan nilai pKa
mereka adalah:
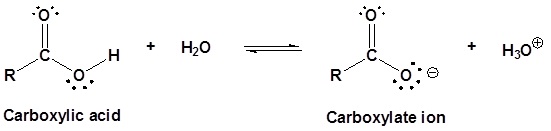
resonansi stabil dari
ion karboksilat mempengaruhi keasaman dari senyawa. Delokalisasi lebih jauh
dari muatan negatif ion karboksilat menstabilkan anion, relative terhadap
asamnya.
keasaman meningkat
ketika kita melewati satu baris dalam tabel periodik. Masuk akal bahwa HF lebih elektronegatif daripada H2O, NH3, dan CH4 karena
elektronegativitas yang lebih besar dari fluor dibandingkan oksigen, nitrogen,
dan karbon. Fluor yang mengandung muatan negatif adalah fluor.

Faktor stabilisasi yang sangat besar untuk basis konjugat adalah jika muatan negatif dapat didelokalisasi melalui resonansi. Contoh klasiknya adalah dengan fenol (C6H5OH) yang sekitar sejuta kali lebih asam dari air, dan dengan asam asetat (pKa ~ 5).
Pemanfataan asam organik yaitu asam benzoat dalam kehidupan sehari hari
Gambar. Struktur asam benzoat
Asam benzoat adalah garam natrium dari asam bezoat yang muncul dan dilarutkan dalam air sehingga asam benzoat ini dapat diproduksi dengan mereaksikan natrium hidroksida dengan asam benzoat jika PH 4-9 ini yang bisa ditolerir oleh tubuh jika PH nya dibwah 4 maka dia dapat bersifat korosif misalnya jika pH 3.5 maka dapat menyebabkan penderita kanker. pH asam benzoat ini adalah 4.2 dimana dengan pH sebesar itu dia dapat menghancurkan sel sel mikroba sehingga asam benzoat ini dapat digunakan bahan pengawet yang terdapat pada makanan dan minuman.
Permasalahannya :
1.
Menurut pendapat anda mengenai struktur diatas mengapa asam trikloroasetat lebih kuat daripada asam dikloroasetat padahal sama sama termasuk golongan asetat ?
2.
1.
Menurut pendapat anda mengenai struktur diatas mengapa asam trikloroasetat lebih kuat daripada asam dikloroasetat padahal sama sama termasuk golongan asetat ?
2.
Jika kita bandingkan kedua struktur diatas berdasarkan nilai pka nya manakah struktur yang memiliki tingkat kekuatan asam yang tinggi dan beserta alasannya mengapa hal itu bisa terjadi
3. perhatikan gambar dibawah ini
jika kita perhatikan isomer
heksena diatas ia hanya memilki perbedaan antara struktur antara cis dan trans
dari posisi saja jelaskan bagaimana menurut tanggapan anda mengenai kejadian
tersebut apakah terjadi memiliki kekuatan asam yang sama atau berbeda pula
tingkat kekuatan asamnya ?












:strip_icc():format(jpeg)/kly-media-production/medias/2438920/original/018641400_1542965298-ganti-msg-atau-penyedap-rasa-dengan-bahan-alami-ini.jpg)