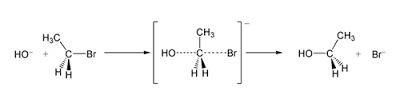
Sesuai dengan konsep yang dinyatakan bahwasanya reaksi eliminasi yang sering kita dengarkan dan mungkin sudah mempelajarinya karena reaksi eliminasi itu dapat diartikan sebagai "penghilang" kemudian didalam reaksi ini juga terdapat 2 atom dimana masing masing terikat dengan atom c jika kita lihat dari sisi daerah letaknya mereka sangat berdampingan dan dipisahkan oleh suatu reaktan sehingga nantinya dapat menghasilkan ikatan rangkap. Karena juga didalam reaksi E 1 ini dapat memberikan proton kepada basa dimana dala keadaan reaksi eliminasi maka dari itu, menjadi sebuah alkena :
Contoh :
Dilihat dari sudut pandang adanya suatu karbokation yang memilki zat yang tidak stabil sehingga menyebabkan memiliki energi yang sangat tinggi .dan reaksinya berjalan secara terus menerus untuk mencapai produk yang stabil untuk itu maka dapat bereaksi dengan nukleofil . Maka dari itu karbokation merupakan salah satu cara untuk membuat produk itu kembali stabil.
Didalam reaksi E 1 terbagi menjadi 2 tahap:
1. Tahap lambat
Dimana pada tahap lambat ini dia dijadikan sebagai tahap penentu laju, pada reaksi keseluruhan. Bisa kita balik ke pelajaran sebelumnya SN 1 disana dia menunjukkan bahwa reaksi E 1 sebagai kinetika order pertama, dengan adanya laju reaksi mereka hanya bergantung pada konsentrasi alkil halida saja dan hanya melibatkan keadaan transisi tetapi dari tahap penentu saja . Dapat dikatakan bahwa reaksi E 1 ini termasuk unimolekul sama halnya dengan reaksi SN 1 .
2. Tahap cepat
Pada tahap cepat ini reaksi eliminasi terjadinya pertempuran basa merampas proton dari atom karbon dimana keadaan letaknya pada saat berdampingan dengan karbon postif . Sehingga elektron yang tadinya sedang berikatan dengan sigma karbon . Dan hidrogen pun bergeser ke arah muatan positif , dan atom karbon dalan reaksi E 1 akan mengalami rehi ridasi dari keadaan sp3 ke keadaan sp 2 sehingga terbentuklah sebuah alkena .
Jadi , initinya peristiwa reaksi SN 1 sama halnya reaksi E 1 karena terjadinya pertemuan zat antara karbokation jadi jangan diherankan lagu jika ada alkil halida tersier bereaksi lebih cepat daripada alkil halida yang lainnya. Kemudian reaksi E 1 dan SN 1 ini terjadinya persaingan antara keduanya .
Permasalahan :
1. Jelaskan perbedaan tahap cepat dan tahap lambat?
2. Mengapa reaksi E 1 dan SN 1 dapat dikatakan sebagai reaksi bersaingan ?
3.Bagaimana caranya karbokation itu bisa mencapai produk yang stabil sedangkan karbokation sendirikan merupakan suatu zat antara tidak stabil tapi memiliki energi yang tinggi ?